Inteligência Artificial no Auxílio ao Diagnóstico da Doença de Alzheimer

Este artigo da Beyond the Horizon é um daqueles que, quando a gente lê, dá orgulho de ser brasileiro! Brilhante trabalho dessa equipe multidisciplinar da UNICAMP aplicando Inteligência Artificial no diagnóstico médico por imagens. Um avanço importante no diagnóstico de Alzheimer, mas que pode beneficiar outras doenças também. Como os autores descrevem, esse trabalho já recebeu destaque e reconhecimento internacional pelo seu desempenho e eficácia. Merece reconhecimento e divulgação na nossa comunidade também.
Boa leitura!
Inteligência Artificial no Auxílio ao
Diagnóstico da Doença de Alzheimer
Por Guilherme Folego, Marina Weiler, Raphael F. Casseb, Ramon Pires, e Anderson Rocha
A demência causada pela doença de Alzheimer atinge mais de 1 milhão de pessoas no Brasil (Associação Brasileira de Alzheimer, 2020) e cerca de 55 mil casos são diagnosticados a cada ano (Herrera et al., 2002), sendo essa a principal forma de demência em idosos. De acordo com a Alzheimer’s Association, a doença de Alzheimer mata mais que o câncer de mama e de próstata combinados, e é a sexta principal causa de morte nos Estados Unidos (Alzheimer’s Association, 2018). O diagnóstico e o tratamento precoces são as principais ferramentas de combate a essa doença que ainda não tem cura.
Problemas cognitivos relacionados à perda de memória são o principal impacto dessa doença, mas outras funções de linguagem e habilidades visuoespaciais também são afetadas. Isso acontece devido a alterações em proteínas cerebrais, que geram uma sequência de eventos culminantes em perda de volume cerebral. Essa perda de volume, ou atrofia cerebral, pode ser visualizada in vivo por imagens de ressonância magnética.
O diagnóstico da doença por profissionais da saúde é sobretudo clínico, levando-se em consideração os déficits cognitivos apresentados pelo paciente. Há alguns anos, entretanto, os padrões das imagens cerebrais passaram a ser aceitos como evidência de degeneração neurológica (Sperling et al., 2011), ajudando no diagnóstico da doença. Como as diferenças nos padrões das imagens podem ser muito sutis, especialmente nos casos iniciais da doença, é difícil para os profissionais da saúde perceberem essas diferenças na visualização.
É aqui que a inteligência artificial pode ajudar…
Na nossa pesquisa (Folego et al., 2020), aplicamos algoritmos de inteligência artificial e visão computacional nas imagens de ressonância magnética para aprender a reconhecer e detectar as alterações no cérebro causadas pela doença.
Mais especificamente, utilizamos uma técnica de aprendizado em profundidade (deep learning) chamada rede neural convolucional. A partir de uma imagem de ressonância magnética, realizamos a classificação entre indivíduos cognitivamente normais, indivíduos com comprometimento cognitivo leve, ou indivíduos com atrofia cerebral característica da doença de Alzheimer.
Nossos avanços
Para treinar nossos algoritmos de inteligência artificial, nós coletamos o maior conjunto de imagens já utilizado em qualquer trabalho nessa área, unificando diversas bases de imagens públicas disponíveis na internet – totalizando mais de 20.000 imagens!
E enquanto as redes neurais convolucionais tradicionalmente lidam com imagens 2D, as nossas imagens de ressonância magnética usam imagens 3D de alta resolução, como ilustrado a seguir.
Exemplo de imagem 3D recortada ao meio utilizada
para visualização no nosso modelo
Nossos resultados são bastante promissores!
Submetemos nosso trabalho para um desafio organizado pelo CADDementia (Bron et al., 2015), baseado em um conjunto de dados de testes independente. Nesse desafio, não tivemos acesso ao diagnóstico dos indivíduos, e nossos algoritmos fizeram uma classificação cega baseando-se apenas nas imagens cerebrais. Nosso modelo superou o resultado da maior parte dos métodos no CADDementia, e teve diferença estatística apenas do primeiro colocado!
Outros trabalhos anteriores ao nosso utilizaram algum outro tipo de informação clínica do indivíduo, como dados demográficos de risco ou regiões cerebrais já afetadas pela doença.
Nosso algoritmo não necessita de informações prévias sobre os indivíduos ou específicas da doença, sugerindo que podemos contribuir no diagnóstico por imagem em outros contextos além da doença de Alzheimer.
Um outro diferencial entre o nosso trabalho e os demais submetidos ao desafio foi o fato de que o nosso método recebeu o cérebro inteiro como entrada e aprendeu automaticamente as regiões e os padrões mais relevantes para realizar a classificação dos pacientes. Isso indica que nossa abordagem pode corroborar achados médicos prévios e possivelmente até contribuir com novos achados.
Vale ainda ressaltar que o nosso sistema retorna o resultado em poucos minutos, enquanto que outros métodos previamente descritos na literatura levam algumas horas para obter a resposta.
Na prática, uma especialista, ao realizar o diagnóstico, coleta diversas informações e dados do paciente, sendo a imagem de ressonância magnética uma delas. Nosso sistema auxilia o profissional ao avaliar a imagem de ressonância magnética e ao indicar as regiões na imagem que foram mais relevantes para a tomada de decisão do algoritmo (figura abaixo). Assim, conseguimos fazer com que o diagnóstico seja mais rápido e mais preciso.
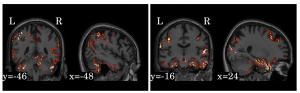
Visualizações para interpretação dos resultados gerados pela rede neural convolucional que desenvolvemos. Imagens de (Folego, 2018). Todas as imagens são de um paciente com doença de Alzheimer, e as regiões coloridas com cores mais claras são consideradas mais relevantes na tomada de decisão do algoritmo.
Em busca de parcerias
Existem diversas possibilidades para dar continuidade a essa pesquisa. Do ponto de vista técnico e acadêmico, é possível explorar arquiteturas de redes neurais convolucionais diferentes e mais recentes, trabalhar com outras técnicas como o aprendizado de dissimilaridade (metric learning), e utilizar informações adicionais que representem dados de risco à doença (como sexo e idade). Além disso, seria interessante avaliar técnicas de aprendizado com poucos dados, considerando o contexto de transferência de conhecimento para um conjunto de dados novo, seja no desafio ou no mundo real, além do uso de dados gerados sinteticamente.
A princípio, nosso método pode ser diretamente aplicado em outras doenças cujo diagnóstico pode ser auxiliado por imagens de ressonância magnética. Fica aberta uma possibilidade de exploração do método para aqueles que estiverem interessados.
Nosso desejo é formar parcerias com grupos de especialistas, na academia e fora dela, para avaliar o comportamento do nosso modelo na prática. Um passo nesse sentido é a disponibilização de forma aberta e gratuita do nosso código e do nosso modelo para livre uso da comunidade.
E essa é nossa gotinha de contribuição para o oceano de conhecimento científico do mundo.
Para mais informações e detalhes, o artigo é de acesso aberto e gratuito, nesse link.
Referências
Associação Brasileira de Alzheimer (2020). O que é Alzheimer. Disponível em: <https://abraz.org.br/web/sobre-alzheimer/o-que-e-alzheimer>. Acesso em: 11 outubro 2020.
Alzheimer’s Association (2018). Alzheimer’s disease facts and figures. Alzheimer’s & Dementia, 14(3):367–429.
E. Bron; M. Smits; W. M. van der Flier; et al. (2015) Standardized evaluation of algorithms for computer-aided diagnosis of dementia based on structural mri: The CADDementia challenge. NeuroImage, 111:562–579.
Folego (2018). ADNet: computer-aided diagnosis for Alzheimer’s disease using whole-brain 3D convolutional neural network. 2018.
Folego, M; Weiler, R. F. Casseb; R. Pires; A. Rocha (2020). Alzheimer’s Disease Detection through Whole-Brain 3D-CNN MRI. Frontiers in Bioengineering and Biotechnology, 8, 1193.
H. Gylys, J. A. Fein, F. Yang, et al. (2004). Synaptic changes in Alzheimer’s disease: Increased amyloid-β and gliosis in surviving terminals is accompanied by decreased psd-95 fluorescence. The American Journal of Pathology, 165(5):1809–1817.
J. Herrera, P. Caramelli, A. S. B. Silveira, et al. (2002) Epidemiologic survey of dementia in a community-dwelling brazilian population. Alzheimer Disease & Associated Disorders, 16(2):103–108.
J. Selkoe (2001). Alzheimer’s disease: Genes, proteins, and therapy. Physiological Reviews, 81(2):741–766. PMID: 11274343.
A. Sperling, P. S. Aisen, L. A. Beckett, et al. (2011). Toward defining the preclinical stages of Alzheimer’s disease: Recommendations from the national institute on aging Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimer’s & Dementia, 7(3):280–292.
Sobre os autores
 Guilherme Folego possui graduação e mestrado em Ciência da Computação pela Universidade Estadual de Campinas (Unicamp). Atualmente é pesquisador e líder técnico no CPqD em Inteligência Artificial. Tem experiência na área de Ciência da Computação, com ênfase em Aprendizado de Máquina, e Visão Computacional. Demonstra especial interesse nas interações entre aprendizado de máquina, visão computacional e medicina.
Guilherme Folego possui graduação e mestrado em Ciência da Computação pela Universidade Estadual de Campinas (Unicamp). Atualmente é pesquisador e líder técnico no CPqD em Inteligência Artificial. Tem experiência na área de Ciência da Computação, com ênfase em Aprendizado de Máquina, e Visão Computacional. Demonstra especial interesse nas interações entre aprendizado de máquina, visão computacional e medicina.
 Raphael F. Casseb é físico médico e doutor em Ciências pela Unicamp. Trabalhou com diferentes doenças degenerativas do sistema nervoso para tentar melhor compreendê-las e para identificar biomarcadores que auxiliassem no diagnóstico e prognóstico das doenças. Durante o pós-doutorado na Universidade de Calgary (Canadá), fez pesquisas envolvendo concussão. Atualmente trabalha com epilepsia e redes neurais em seu pós-doutorado na Unicamp. Seu principal foco é a análise de imagens de ressonância magnética usando métodos matemáticos para contribuir com o avanço da Neurociência. Também possui interesse em estados alterados de consciência (meditação, coma, entre outros).
Raphael F. Casseb é físico médico e doutor em Ciências pela Unicamp. Trabalhou com diferentes doenças degenerativas do sistema nervoso para tentar melhor compreendê-las e para identificar biomarcadores que auxiliassem no diagnóstico e prognóstico das doenças. Durante o pós-doutorado na Universidade de Calgary (Canadá), fez pesquisas envolvendo concussão. Atualmente trabalha com epilepsia e redes neurais em seu pós-doutorado na Unicamp. Seu principal foco é a análise de imagens de ressonância magnética usando métodos matemáticos para contribuir com o avanço da Neurociência. Também possui interesse em estados alterados de consciência (meditação, coma, entre outros).

Marina Weiler possui graduação em Ciências Biológicas pela UFRGS e doutorado em Ciências Médicas pela Unicamp, onde estudou biomarcadores de imagem de ressonância magnética na Doença de Alzheimer. Durante o seu pós-doutorado no National Institutes of Health (NIH), Estados Unidos, estudou métodos eletromagnéticos de estimulação cerebral no tratamento de problemas de memória relacionados com a idade em modelos animais. Atualmente, faz pesquisa com biomarcadores de imagem de ressonância magnética em pacientes em coma e estado vegetativo na UCLA, Estados Unidos. Seu principal interesse é utilizar métodos de neuroimagem para entender o funcionamento do cérebro e da consciência humana.

Anderson Rocha é Professor Associado do Instituto de Computação na Unicamp. É membro afiliado da Academia Brasileira de Ciências e da Academia Brasileira de Ciências Forenses. Devido à sua pesquisa de impacto, tem recebido reconhecimentos importantes ao longo dos anos como o Microsoft, Google e Tan Chi Tuan Faculty Fellowships. Suas áreas de interesse incluem Inteligência Artificial e Computação Forense. Suas pesquisas têm sido aplicadas em diferentes áreas do conhecimento, start-ups, governos e empresas nacionais e multinacionais. É coordenador do Laboratório de Inferência em Dados Complexos (RECOD) na Unicamp que conta com cinco outros professores e cerca de 60 pesquisadores entre alunos de graduação, mestrado, doutorado e pós-doutorado.
Como citar esse artigo:
Folego, G., Weiler, M. Casseb, R., Pires, R., Rocha, A. 2020. Inteligência Artificial no Auxílio ao Diagnóstico da Doença de Alzheimer . ISSN: 2175-9235. Disponível em: http://horizontes.sbc.org.br/index.php/2020/11/ia-diagnostico-alzheimer/





